U rễ
Giới thiệu chung
U RỄ BẮP CẢI (Plasmodiophora brassicae)
Trên bắp cải cùng với vi khuẩn gây thối nhũn – Ewinia carotovora (L.R. Jones) Holland, nấm gây thối rễ – Rhizoctonia solani Kűhn, tuyến trùng hại rễ – Meloidogyne spp., thì Plasmodiophora brassicae cũng là một tác nhân đem lại những thiệt hại đáng kể.
P. brassicae là loài ký sinh gây bệnh u rễ (clubroot disease) trên bắp cải cũng như nhiều cây trồng khác thuộc họ Hoa Thập Tự – Brassicaceae (Cruciferae) như cải dầu, bông cải xanh, cải bruxen, cải bắp, cải xoăn, su hào, củ cải, súp lơ, củ cải và mù tạt đen….1,2,3,4,5,6,7 Có nhiều báo cáo từ cuối những năm 1800 cho đến đầu thế kỷ 20 cho thấy P. brassicae có thể hủy diệt từ 50% đến 100% củ cải Thụy Điển và bắp cải ở Đức, Anh, Mỹ, Liên Xô cũng như các nước khác ở châu Âu, châu Á và Nam Phi (Colhoun năm 1958; Karling, 1968). Tại Nhật Bản, u rễ xảy ra với mức độ nghiêm trọng ngày càng tăng trong cả nước (Yoshikawa và Buczacki, 1978). Tại Úc, nơi thiệt hại hàng năm của cây họ hoa thập tự do P. brassicae được ước tính ít nhất là 10% (Faggian et al., 1999). Trong những năm gần đây sản lượng mù tạt Tứ Xuyên, bắp cải giảm đáng kể đã được báo cáo từ Đài Loan (Hsieh và Yang, 1985). Năng suất mù tạt ở Ấn Độ giảm 32,5% (Laha et al., 1985).
Bệnh u rễ trên cây trên rau họ hoa thập tự nói chung và bắp cải nói riêng do P. brassicae đã xuất hiện ở nước ta từ cuối những năm 90 của thế kỷ trước và gây thành dịch trên vùng trồng rau Đà Lạt – Lâm Đồng trong năm 2003. Hiện nay bệnh đang lây lan mạnh và gây tổn thất lớn ở một số vùng trồng rau Lâm Đồng và các địa phương lân cận như Lạc Dương, Đơn Dương, Đức Trọng. Hàng năm bệnh gây hại hàng ngàn ha cây rau họ thập tự: năm 2005 (320 ha); năm 2008 (2.244,5 ha); năm 2010 (3.224 ha); năm 2013 (1.010,9 ha); 6 tháng đầu năm 2014 (381 ha). Tỷ lệ hại trung bình 9,6 – 56,2%, một số diện tích tỷ lệ hại lên tới 80% hoặc mất trắng (theo báo cáo của Chi cục BVTV Lâm Đồng).
Tác động của P. brassicae chưa bao giờ lớn như ngày nay vì sự đa dạng địa lý của cây họ hoa thập tự.
Những quan sát ban đầu từ thế kỷ 13 được cho là liên quan đến bệnh u rễ bắp cải (Böhner, 1922). Triệu chứng bệnh của bắp cải đã được mô tả ở Tây Ban Nha vào thế kỷ thứ 16. Các báo cáo về bệnh này xuất hiện năm 1736 ở Anh và sau đó ở Na Uy vào năm 1855, ở Scotland vào năm 1870 (Karling, 1968). Các báo cáo về bệnh này từ Phần Lan có niên đại từ năm 1860 (Jamalainen, 1936). Tuy nhiên, phải đến năm 1869, khi những cánh đồng cải bắp ở ngoại ô St Petersburg bị tàn phá nặng nề, thì nhà khoa học Nga Mikhail Woronin sau quá trình nghiên cứu cuối cùng đã xác định được nguyên nhân gây u rễ như là một “sinh vật plasmodiophorous” vào năm 1875 và đặt tên cho nó là Plasmodiophora brassicae. Sau đó u rễ được quan sát và mô tả khắp châu Âu như ở Đan Mạch (Christensen et al., 1909) và Thụy Điển (Eriksson, 1906). Nó lần đầu tiên được báo cáo tại Nhật Bản trên bắp cải vào năm 1892 (Yoshikiawa và Buczacki, 1978) và những thiệt hại nghiêm trọng do P. brassicae ở Mỹ cũng được công bố (Halsted, 1894).8
P. brassicae lây nhiễm hơn 300 loài trong 64 chi họ thập tự bao gồm cả những cây trồng và hoang dã như Raphanus raphanistrum, Capsella bursa-pastoris, Arabidopsis thaliana (các loài thực vật có hoa trong họ Cải).5,6,7
Bệnh u rễ không chỉ tác động đến sinh trưởng của các loại rau họ Thập tự mà còn ảnh hưởng đến chất lượng sản phẩm cuối cùng (ví dụ như bắp cải bị bệnh có kích thước nhỏ, khối lượng thấp, bắp cuốn không chặt). Đối với các loại cây thu hoạch thân ngầm như củ cải bệnh cũng làm giảm giá trị thương phẩm. Ngoài ra, trên những cánh đồng bị nhiễm P. brassicae sẽ ảnh hưởng rất lớn đến những cây họ thập tự trong công thức luân canh tiếp theo.8
1.1 Triệu chứng
Trên mặt đất cây bị bệnh có triệu chứng còi cọc, lá héo vào ban ngày và có thể phục hồi vào chiều tối hoặc khi nhiệt độ ban ngày thấp. Bệnh phát triển không đều khắp mà thường tập trung vào những khu đất thấp, độ ẩm cao trên cánh đồng.5,11 Hình 1.
 |
 |
 |
| Hình 1: Triệu chứng của P. brassicae trên đồng ruộng. | ||
Do hệ thống rễ bị hại nên xuất hiện những biểu hiện “rối loạn sinh lý” trên bề mặt lá của cây bệnh (nhăn nheo, không phẳng, bạc màu).12 Hình 2.
 |
 |
| Hình 2: Biểu hiện bệnh u rễ trên lá bắp cải. | |
Trên những cây non nếu điều kiện thời tiết thuận lợi cho mầm bệnh phát triển, mật độ bào tử trong đất cao thì có thể làm cho cây chết. Đối với những cây trưởng thành hiện tượng chết cây không xảy ra.
Những biểu hiện trên cũng xuất hiện trên những cây giống.
Dưới mặt đất, rễ của bắp cải (kể cả rễ sơ cấp, rễ phụ, rễ cái và thậm chí thân ngầm) tăng kích thước một cách bất thường (kiểu phát triển của tế bào ung thư) hình thành nên những khối u khổng lồ. Các khối u thường là dày nhất ở trung tâm và giảm dần về phía đầu. Khối u có thể bị cô lập và chỉ bao gồm một phần của một số rễ hoặc có thể hợp lại và bao trùm toàn bộ hệ thống rễ của cây. Hình 3. Với sự xuất hiện của P. brassicae trong tế bào rễ đã kích hoạt việc sản xuất các auxin, cytokinin và điều hòa sinh trưởng thực vật khác từ đó chuyển hướng một phần đáng kể nguồn dinh dưỡng vào quá trình tăng trưởng phì đại của các tế bào ở mô rễ. Kích thước có thể phóng to lên đến 20 lần so với kích thước bình thường của nó.5 Kết quả dẫn đến sự hình thành các u sưng.2,9 Một số cây bị bệnh có thể không có biểu hiện triệu chứng trên mặt đất cho đến khi cây được nhổ lên cùng với các khối u trên rễ (Sherf và MacNab, 1986; Agrios, 1978).
 |
 |
 |
| Hình 3: Các khối u do P. brassicae gây ra trên rễ bắp cải. | ||
Bệnh tiếp tục phát triển thì cuối cùng rễ sẽ thối và cây sẽ chết.2
Tuy nhiên, trên bắp cải triệu chứng hình thành u sưng cũng được gây ra bởi những tác nhân khác. Chẳng hạn như vi khuẩn Agrobacterium tumefaciens (họ Rhizobiaceae) còn gọi là Rhizobium radiobacter, Physoderma sp., Spongospora sp., và tuyến trùng rễ Meloidogyne spp.1 Trên cây họ Thập tự các khối u cũng thường bị nhầm lẫn với triệu chứng gây hại của một loại côn trùng. Đó là mọt củ cải mật (Ceutorhyncus pleurostigma) với những vết sưng cứng ở gốc không rõ ràng.4,8 Hoặc các triệu chứng gây ra bởi ứng dụng sai thuốc diệt cỏ – nhóm dinitroaniline (Rod 1996).9
(Để phân lập P. brassicae trong rễ người ta thu thập các u còn tươi hoặc đã được đông lạnh nhưng đã bị lây nhiễm ít nhất 5 tuần. Sau đó làm sạch, xắt nhỏ, trộn với nước, và xay ở tốc độ cao trong một máy xay sinh tố cho đến khi mịn là được. Lọc dung dịch qua vải. Ly tâm lọc trong 7 phút, hoặc cho đến khi ba lớp riêng biệt có thể được nhìn thấy. Lớp đáy là các mảnh vỡ. Ở giữa là các lớp màu trắng (chủ yếu là tinh bột) và trên cùng là chất lỏng màu xám chứa nang P. brassicae. Đổ u nang ra và lặp lại quá trình ly tâm để làm sạch hơn nữa cho quá trình phân lập)5.
Trên rễ bắp cải có tuyến trùng Meloidogyne javanica và Plasmodiophora brassicae cùng gây hại với triệu chứng làm sưng rễ. Đây là hai tác nhân gây hại khác nhau về nguyên nhân cũng như vị trí gây hại trên rễ, hình thái khối u sưng,…
 |
|
Hình 4: Bộ rễ với những u sưng to do P. brassicae (B); Bộ rễ với những nốt sưng do M. javanica (F). |
Ký sinh của M. javanica được đặc trưng bởi sự hình thành các điểm ký sinh lâu dài rõ rệt với các tế bào khổng lồ ở lớp vỏ của rễ, nội bì và mạch dẫn của nhu mô.
Đối với P. brassicae, các plasmodium (các tài liệu chuyên ngành bệnh cây ở Việt Nam gọi là nguyên sinh bào hoặc hợp bào) đã xâm nhập vào trong các tế bào của lớp vỏ của rễ và trụ bì, gây phì đại và tăng kích thước một cách bất thường. Ở đó phát triển thành các bào tử nghỉ ngơi.
Xem cấu tạo của rễ ở hình 5.
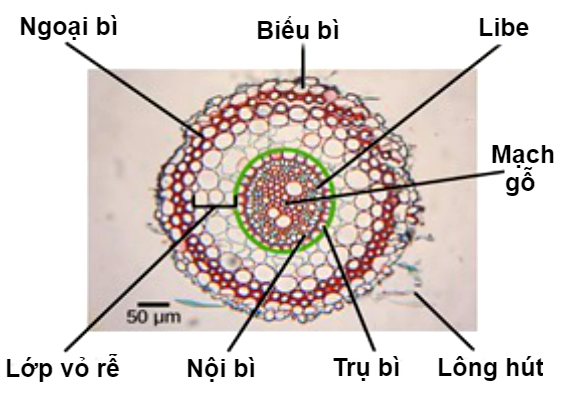 |
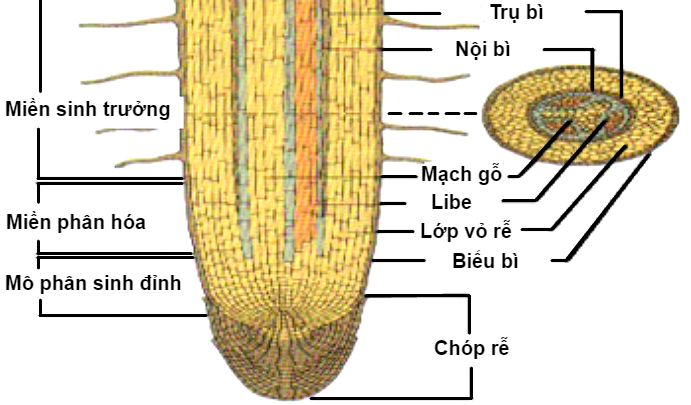 |
| Hình 5: Cấu tạo của rễ. | |
U rễ do M. javanica xảy ra trên cả rễ chính và rễ con. Đa dạng về kích thước và hình dạng. Trong các u sưng chứa một hoặc nhiều tuyến trùng cái, đực và trứng. Có từ 4.100 đến 6.800 trứng và J2/g rễ tươi.1 Nói chung, các u sưng thường có mặt trên chóp rễ và dọc theo trục rễ. U sưng xảy ra hoặc đơn lẻ hoặc trong các cụm, có thể bao vây toàn bộ gốc và dẫn đến biến dạng rõ rệt hình thái gốc. Trong trường hợp này, đường kính gốc tăng 4 – 8 lần so với rễ không bị nhiễm bệnh. Tuyến trùng sau khi cố định vị trí trong mô rễ đã gây ra sự biến đổi tế bào mà hình thành nên các tế bào khổng lồ. Trong hầu hết các trường hợp, tại các vị trí cố định đó tiếp giáp với các mô mạch dẫn bao gồm các nhóm 2 – 4 các tế bào khổng lồ, nhưng đôi khi 3 – 6 tế bào khổng lồ cũng thường quan sát được. Thông thường, ở các vị trí gây hại này tuyến trùng gây ra biến dạng nghiêm trọng mô xylem.1
Đối với P. brassicae, sau khi xâm nhiễm vào trong rễ thúc đẩy sự gia tăng bất thường trong phân chia tế bào và kích thích các tế bào phát triển vô tổ chức tạo nên các u sưng. Khi các tế bào bị sưng lên đến kích thước bất thường, các phần của mạch gỗ được đẩy sang một bên dẫn đến quá trình vận chuyển nước bị cản trở. Nguyên nhân cây bị héo từ đây. Các tế bào bị nhiễm co cụm lại với các kích thước khác nhau khiến cho các mô bệnh bị bao quanh bởi các tế bào khỏe mạnh.
1.2 Nguyên nhân
U rễ bắp cải được gây ra bởi các tác nhân Plasmodiophora brassicae.
Có một thực tế cho thấy rằng Plasmodiophora brassicae chính thức được xác định là nguyên nhân gây sưng rễ do M. Woronin từ năm 1875. Nhưng cho đến nay, hơn 130 năm sau vẫn còn nhiều điều chưa biết rõ về phân loại, toàn bộ vòng đời và sự tương tác của tác nhân gây bệnh này với ký chủ của nó.
Ban đầu M. Woronin (1875) mô tả P. brassicae và phân loại xếp nó vào lớp nấm nhầy thuộc giới Protoza (động vật nguyên sinh).2,3 Sau đó được khẳng định bởi E. Häckel (Chupp, 1934). Lúc đó P. brassicae được xác định như một sinh vật đơn bào mà tương đồng với các loại nấm thuộc lớp Myxomycetes nhưng có sự sai khác về phương thức sinh sản và cấu trúc tế bào (sự vắng mặt của một màng bọc bào tử đúng nghĩa của nó).
P. brassicae sau đó đã được phân loại lại nhiều lần. Người ta chuyển P. brassicae từ Protozoa qua Proteomyxa, Mycetozoa, Chytridiales, Archimycetes và nhiều phân loại khác cũng được công bố (Karling, 1968; Buczaki, 1983).
Hiện nay P. brassicae được đặt trong Lớp Phytomyxea, Bộ Plasmodiophorales, Họ Plasmodiophoraceae (Braselton 1995).2,3,4 Nhưng cũng có tài liệu xếp trong Lớp Plasmodiophoromycota, Bộ Plasmodiophorales, Họ Plasmodiophoraceae, Chi Plasmodiophora.12
Một số tài liệu của Việt Nam xếp P. brassicae vào Lớp Myxomycetes (Giáo trình Bệnh cây đại cương ĐHNN I) hoặc Plasmodiophoromyces (Vu Thanh Luan).
P. brassicae có một vòng đời gồm ba giai đoạn: Tồn tại trong đất bằng u nang; Xâm nhiễm vào lông hút (xâm nhiễm ban đầu – sơ cấp) của rễ cây chủ và xâm nhiễm vào lớp vỏ rễ (xâm nhiễm thứ cấp – xâm nhiễm lần thứ hai). Hình 6.
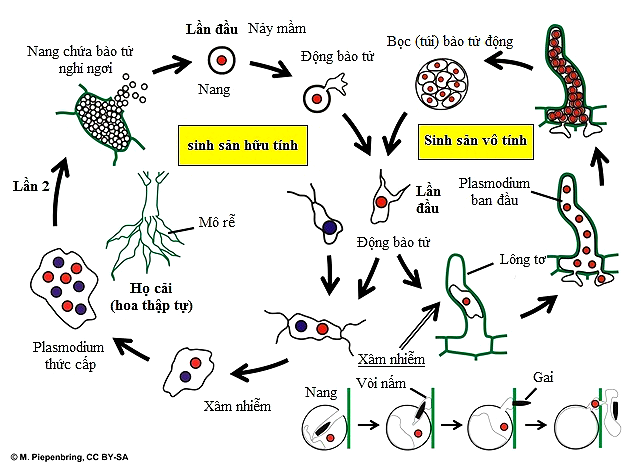
Hình 6: Chu trình sống của P. brassicae.
Khi bắp cải được trồng trên đồng thì các bào tử nghỉ ngơi (được phóng thích từ các u nang. Hình 7) nảy mầm hình thành các động bào tử đơn bào sơ cấp có 2 roi tiếp cận rễ cây bằng hướng hóa và xâm nhập vào lông hút của rễ (hình 8). Đây chính là xâm nhiễm ban đầu. Các động bào tử gắn liền lông hút và tạo thành một cấu trúc hình viên đạn (Stachel) buộc nó phải chấp nhận cho động bào tử xâm nhiễm vào bên trong. Ở đó chúng hình thành các plasmodium (còn gọi là nguyên sinh bào hoặc hợp bào – khối nguyên sinh chất có chứa nhiều nhân. Cấu tạo, hình dáng và cách thức di chuyển như amip). Sau một quá trình chia tách nhân sẽ hình thành 4 – 16 động bào tử thứ cấp13 (có tài liệu 10 – 20)4. Chúng có khả năng lây nhiễm cho lông rễ khác hoặc liên kết với nhau để hình thành các tế lớn hơn. Quá trình này kéo dài trong 5-7 ngày (Dixon 2009b).13Thời gian khi động bào tử tự do trong đất là khoảng thời gian dễ bị tổn thương nhất trong chu kỳ sống của P. brassicae (Dixon 2009b).
Nảy mầm của bào tử nghỉ ngơi là do dịch tiết ra từ gốc của các ký chủ, pH của đất hoặc thậm chí một số vi sinh vật khác (Dixon 2009b). Số lượng bào tử nảy mầm phát triển với một số lượng ngày càng tăng của dịch tiết rễ của cây chủ (MacFarlane và Last 1957). Vi khuẩn Bacillus spp. và Pseudomonas spp. có thể kích thích bào tử nảy mầm (Einhorn et al. 1991) trong khi các loại nấm đất Heteroconium chaetospira có thể ngăn chặn nó (Narisawa et al. 2005).13
Những động bào tử được phóng thích từ các bọc bào tử động (hình thành sau khi xâm nhiễm lông hút) lại xâm nhiễm vỏ rễ và bắt đầu giai đoạn thứ hai của chu kỳ sống. Ở đây chúng phát triển thành các plasmodium thứ cấp gây phì đại các tế bào rễ bằng các kích hoạt các hoóc môn thực vật (cytokinin và auxin) từ đó hình thành nên các u sưng có chứa các tế bào nghỉ ngơi. Các bào tử này được phóng thích vào đất trong các nang khi rễ chết. Triệu chứng u sưng phát triển trong vòng 3-4 tuần sau xâm nhiễm.4
Hình 7: Động bào tử được phóng thích từ u nang. Ảnh: Ian Porter and Caroline Donald, DPI Victoria.7
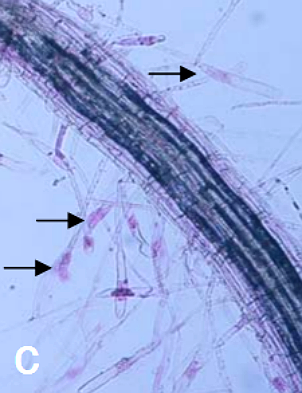
Hình 8: Lông hút có chứa động bào tử trên rễ bông cải xanh (mũi tên). Ảnh: Ian Porter and Caroline Donald, DPI Victoria.7
Nang chứa bào tử nghỉ ngơi có kích thước 1.6 – 4.3µm (hình cầu), 4.0 – 6.0µm (hình elip), đôi khi thon dài với kích thước 2.5 – 6.9µm. Các nang không màu, có màng mỏng bên ngoài.12
Các động bào tử ban đầu (Nảy mầm từ nang. Chỉ xâm nhập qua lông hút) hình quả lê hoặc hình bầu dục có đường kính 2.5 – 3.5µm. Bào tử có hai roi. Một ngắn đầu tù, một dài hình roi ngựa. Động bào tử nhỏ, hình trứng gần tròn hoặc hình cầu. Đường kính 6.0 – 6.5µm với lớp màng mỏng.12 Ở trong lông hút các động bào tử hòa nhập với nhau để hình thành plasmodium. Trong mỗi tế bào của rễ bắp cải có chứa một số plasmodium. Plasmodium này phân chia và hình thành nhiều du động bào tử thứ cấp, được phóng thích trở lại đất. Chúng có thể lây nhiễm sang ký chủ đầu tiên (cũ) hoặc các ký chủ xung quanh.
Các nghiên cứu trước báo cáo rằng tuổi của lông rễ có thể ảnh hưởng đến nhiễm trùng P. brassicae (Samuel và Garrett 1945; Naiki và cộng sự 1978). Quá trình xâm nhiễm bắt đầu khoảng 3 ngày sau khi lây nhiễm nhân tạo. Tăng lên vào ngày thứ 6 và sau đó tăng chậm lại cho đến 10-12 ngày sau khi lây bệnh.
Các động bào tử thứ cấp (Chỉ gây hại trong các tế bào vỏ rễ và hình thành từ quá trình phân bào giảm nhiễm plasmodium) có đường kính 1.9 – 3.0µm. Chúng cũng có hai roi với các kích thước và hình dáng khác nhau: roi ngắn giống cái dây thừng, dài 3.4µm; roi dài là giống như cái roi, dài 11.8µm.12 Các động bào tử thứ cấp này có thể lây nhiễm phần vỏ rễ của các cây chủ ban đầu hoặc lây nhiễm cây gần đó. Khi ở trong vỏ rễ, chúng có thể gây bệnh cho rễ hoặc liên kết với nhau để tạo thành một plasmodium thứ cấp.

Hình 9: Các tế bào nghỉ ngơi.
Trong các tế bào vỏ rễ, plasmodium thứ cấp được hình thành có đường kính 100 – 200µm, không màu hoặc màu xám nhạt. Chúng là một khối nguyên sinh chất hoặc đôi khi là một u nang.12 Các plasmodium trong các tế bào ký chủ cuối cùng trải qua giảm phân và phát triển thành u nang chứa các tế bào nghỉ ngơi và phóng thích chúng trở lại vào đất (khi các u bị thối và tan rữa) với cấu trúc bảo tồn là các nang (xem hình 9 và 10). Mỗi ký chủ bị nhiễm có tiềm năng phóng thích 8 x 108 bào tử nghỉ ngơi trở lại đất (Hwang et al. 2011a).
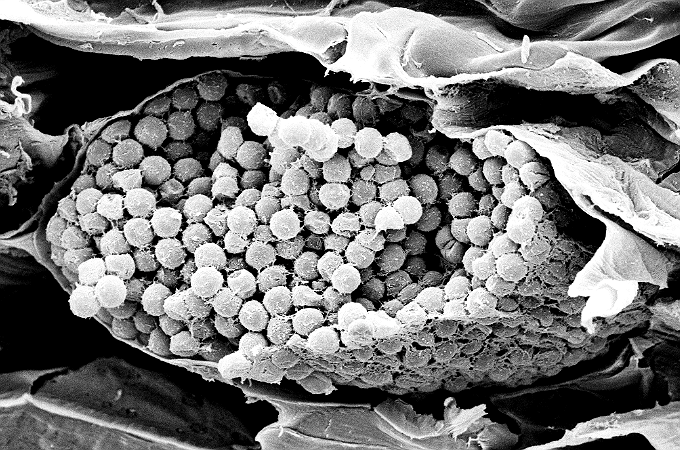
Hình 10: Bào tử nghỉ ngơi trong rễ nhiễm của Brassica rapa var. pekinensis. Kích thước bào tử 3-4μm. Ảnh: Kerstin Brismar và Salla Marttila.
Thành tế bào của bào tử được cấu tạo gồm năm lớp và có chứa: 25,1% chitin, 33,6% protein, 17,5% chất béo, và 2,5% là carbohydrate (cellulose không được xác nhận). Cấu trúc của các bào tử ảnh hưởng đến sự tồn tại trong đất và khả năng chịu hóa chất của chúng (Wallenhammar 2010). Các thành phần protein rất quan trọng trong quá trình nảy mầm (Moxham & Buczacki 1983).13 Hầu hết các bào tử có thể được tìm thấy ở độ sâu 15 cm, tối đa là 40 cm (Kim et al 2000; Dixon 2009b).
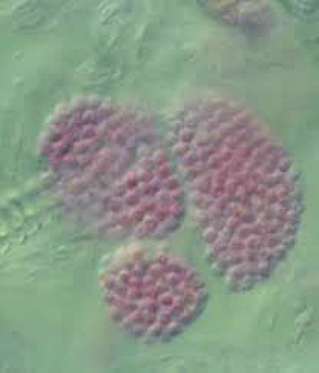
Hình 10: Các tế bào nghỉ ngơi trong u rễ. Ảnh: Ian Porter and Caroline Donald, DPI Victoria.7
Các nang tồn tại trong đất. Nó có thể sống tới 7 – 10 năm mà không có sự hiện diện của ký chủ và chỉ nảy mầm khi có dịch tiết ra từ rễ của ký chủ họ hoa Thập tự.5,7,10,11 Theo Rod (1996) sức sống có thể kéo dài 15 năm hoặc lên đến 20 năm (Wallenhammar 1996).2,13 Còn trong rễ cỏ dại họ cải thì thời gian là vô thời hạn.11 Bào tử nghỉ ngơi nẩy mầm thì thường xâm nhiễm qua lông hút nhưng rễ già cũng có thể bị xâm nhiễm nếu có vết thương xuất hiện cung cấp một lối vào cho mầm bệnh.
Thực tế P. brassicae không thể phát triển trong ống nghiệm, mặc dù giai đoạn amoebal (là giai đoạn mà ký sinh đơn bào không có hình dạng nhất định, tương tự như amip) gần đây đã được nuôi cấy. Chính vì thế sự hiện diện của u rễ chứa bào tử nghỉ ngơi được sử dụng để chẩn đoán bệnh này.
Một số hình ảnh về P. brassicae.
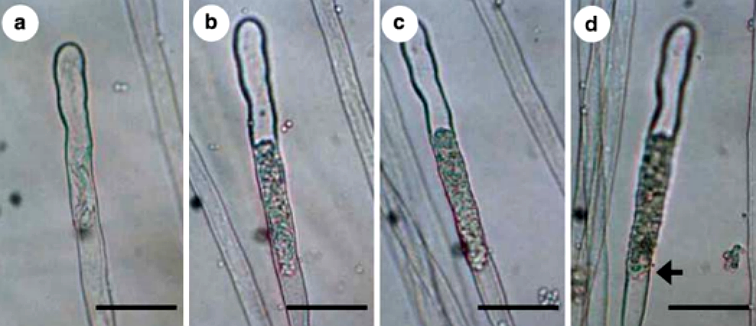
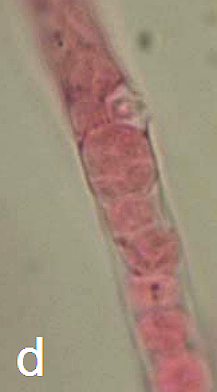
Hình 11: Ảnh chụp quá trình sinh trưởng của P. brassicae trong lông hút riêng lẻ của củ cải sau khi lây nhiễm bằng bào tử nghỉ ngơi 4 (a), 5 (b), 6 (c), 8 (d) ngày.
a. Plasmodium ban đầu không có hình dạng nhất định. b. Động bào tử trẻ phát triển từ plasmodium chính. c. Động bào tử trưởng thành có chứa động bào tử thứ cấp. d. Một nhóm các bọc động bào tử đã phóng thích hết các bào tử. Mũi tên chỉ bọc động bào tử trống rỗng.Tỷ lệ: 50µm.
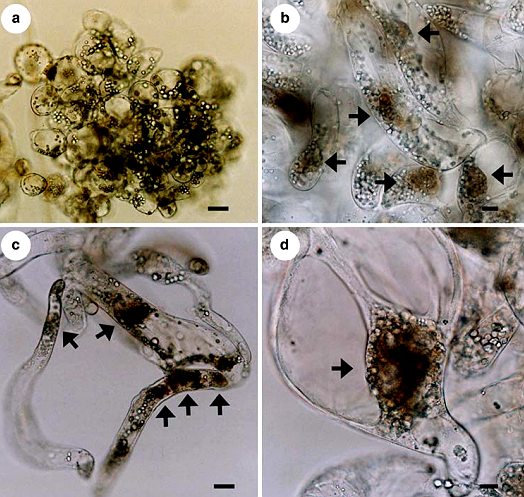
Hình 12: Hình thái tế bào P.brassicae trong môi trường nuôi cấy.
a. Tế bào không bị lây nhiễm. b. Tế bào hình trụ chưa plasmodium thứ cấp (mũi tên). c. Tế bào dạng sợi có chứa plasmodium thứ cấp. d. Một tế bào phát triển dị thường chứa plasmodium thứ cấp (mũi tên). Tỷ lệ: 20µm.
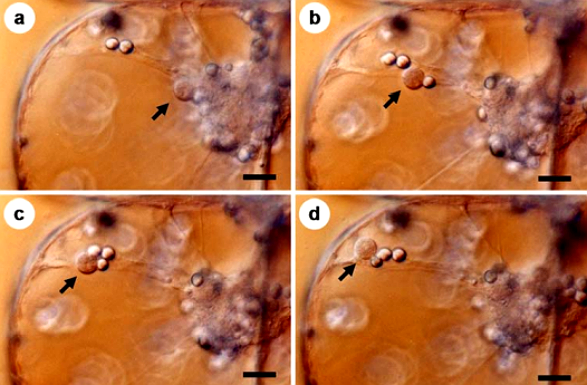
Hình 13: Ảnh chụp Plasodium di chuyển trong 20’ (mũi tên). Tỷ lệ: 20µm.
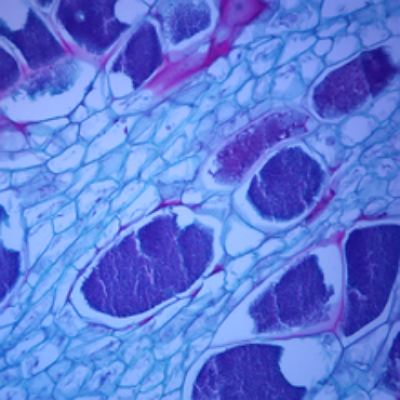
Hình 14: Ảnh chụp lát cắt của rễ cải bắp cho thấy P. brassicae trong tế bào ký chủ. Ký sinh là một khối chất nhầy.
1.3 Phát sinh gây hại
P. brassicae là loài ký sinh đất. Nó tồn tại trong đất bằng các bào tử nghỉ ngơi chứa trong u nang với thời gian dài và được phóng thích vào đất khi rễ chết. Những bào tử này có thể được lan truyền theo bất cứ cách nào có thể như thông qua phương tiện vận chuyển cơ giới; các công cụ, thiết bị hoạt động trên đồng ruộng; nước (nguồn nước tưới bị nhiễm, nước mưa giúp phát tán bệnh,…); gió; động vật và con người. Mặc dù bệnh không lan truyền qua hạt giống, nhưng bắp cải dễ dàng bị nhiễm bệnh khi sử dụng đất có sẵn nguồn bệnh để gieo cấy trong vườn ươm hoặc làm bầu.
Có mấy yếu tố chính chi phối sự phát sinh, phát triển của bệnh: độ pH đất; Độ ẩm đất; Mật độ bào tử; nhiệt độ và sự hiện diện của Canxi, Magiê, Bo, Phốt pho, Nitơ trong đất,….
Độ pH là quan trọng nhất. Bệnh thường phát sinh, phát triển và gây hại nặng trên đất có độ pH < 7.2. Với pH, từ 5,4 đến 6,5 là tối ưu cho bệnh phát triển. Mức độ nghiêm trọng của bệnh tăng theo độ chua của đất. Nếu pH = 6.2 bệnh xảy ra ở tất cả các mật độ bào tử. Tuy nhiên, độ ẩm đất cao và duy trì một thời gian dài cộng với mật độ bào tử cao thì bệnh vẫn phát triển mạnh ngay cả trong điều kiện pH > 7.2. Samuel và Garret (1945) nhận thấy rằng ở độ kiềm cao (pH = 7.2) xâm nhiễm chỉ xảy ra khi nồng độ bào tử nghỉ ngơi cao hơn 106 và 107. Tại pH > 8.0 động bào tử bị dị dạng, không phát triển được và không hình thành u.
Mặc dù độ ẩm đất là nhu cầu thiết yếu cho các loại rau (trong đó có bắp cải) nhưng độ ẩm đất mặt nào đó cũng đem lại những phiền toái nhất định trong việc quản lý bệnh u rễ bắp cải. Bào tử của P. brassicae cần nước tự do để di chuyển trong đất. Trong các loại đất sét, pha sét với khả năng giữ nước cao hoặc ngay cả đất pha cát nhưng khả năng thoát nước kém thì cũng tạo điều kiện cho bệnh phát triển. Nguồn nước tưới có sẵn bảo tử P. brassicae cũng là nguyên nhân cho bệnh bùng phát. Nếu biết rằng sự di chuyển của động bào tử là chỉ trong vòng 10 – 20mm (Dixon 2009b) thì mới thấy biện pháp tưới phun mưa, tưới tràn đã tạo điều kiện như thế nào cho bào tử phát tán theo những giọt nước bắn lên hoặc dòng nước chảy. Độ ẩm đất và pH thấp là môi trường thuận lợi nhất cho các tác nhân gây bệnh.
Naiki và những người khác (1978) nhận thấy rằng bệnh không thể phát sinh nếu có ít hơn 103 bào tử nghỉ ngơi/g đất. Tuy nhiên, mật độ bào tử trong đất không phải là tối quan trọng khi các điều kiện tự nhiên khác không thuận lợi và hỗ trợ cho quá trình nảy mầm bào tử cũng như khả năng tồn tại của động bào tử trong đất. Chính vì thế ngay cả một nồng độ thấp của động bào tử với điều kiện thuận lợi có thể dẫn đến xâm nhiễm thành công (Webster 1986). Trong điều kiện không phù hợp cần phải 50 bào tử hữu hiệu trong 1g đất nhưng trong điều kiện lý tưởng chỉ 1 bào tử trong 10g đất là đủ để quá trình xâm nhiễm xảy ra (Rod 1996).13 Rennie và công sự (2011) cũng có nhận định khi tất cả các điều kiện thuận lợi, một bào tử nghỉ ngơi là đủ để xâm nhiễm vào cây chủ.4
Ảnh hưởng của nhiệt độ chủ yếu là gián tiếp mà không trực tiếp ảnh hưởng đến quá trình xâm nhiễm như pH. Nhiệt độ lý tưởng cho sự phát triển của mầm bệnh khác nhau do các điều kiện tự nhiên, khu vực địa lý và ký chủ bị nhiễm khác nhau (Dixon 2009b). Colhoun (1953) cho rằng nhiệt độ lý tưởng là 23°C. Còn Wellman (1930) cho rằng nhiệt độ lý tưởng là trong khoảng 18 – 24°C và quá trình xâm bị ức chế nếu nhiệt độ dưới 12°C hoặc cao hơn 27°C. Bào tử của tế bào nghỉ ngơi nảy mầm trong sự hiện diện của rễ chủ khi nhiệt độ ít nhất là 16°C, trong khi quá trình xâm nhiễm được ưa chuộng với nhiệt độ trên 18°C và bệnh phát triển mạnh với nhiệt độ tăng lên đến 26°C (Buczacki et al., 1978).1 Nhiệt độ ảnh hưởng khác nhau đến mỗi giai đoạn hình thành và phát triển các u rễ. Ở nhiệt độ 10°C quá trình xâm nhiễm xảy ra sau 42 ngày. Với nhiệt độ 15°C thì quá trình này cũng kéo dài đến 38 ngày. Ở nhiệt độ 20°C và 30°C là 36 ngày, 25°C là 22 ngày. Người ta theo dõi trong 42 ngày với nền nhiệt độ trong phạm vi 20°C – 30°C thì số lượng bào tử nghỉ ngơi hình thành lớn hơn ở nền nhiệt độ 15°C.14
Canxi có một vai trò quan trọng trong xâm nhiễm của P. brassicae. Nồng độ cao của các ion canxi ở pH 6.2 hoặc 7.2 làm giảm tổng số lông hút bị nhiễm và tỷ lệ thành thục của động bào tử (Dixon 2009b). Nồng độ cao hoàn toàn ức chế giai đoạn phát triển sau này của P. brassicae trong lông hút (Dixon 2009b). Dixon và Page (2001) cho thấy sự nảy mầm của bào tử nghỉ ngơi và vận động của động bào tử bị ảnh hưởng trong sự hiện diện của canxi. Canxi oxit tác dụng nhanh chóng và thường được coi là hiệu quả hơn cacbonat canxi để kiểm soát u rễ.
Ngoài ra còn có một mối tương quan mạnh mẽ giữa sự xâm nhiễm của P. brassicae và nồng độ của bo, canxi trong đất (Palm 1963). Bo tương tác với canxi trong ức chế xâm nhiễm, ảnh hưởng chủ yếu đến các động bào tử. Nếu có một sự thiếu hụt bo trong đất, các ion canxi không thể điều chỉnh quá trình hình thành các u rễ. Trong môi trường có nồng độ cao của bo, chức năng ức chế canxi có thể nhìn thấy trong cả hai giai đoạn – xâm nhiễm trùng lông hút và xâm nhiễm trùng vỏ rễ (Webster & Dixon 1991b). Bo làm chậm sự phát triển các túi bào tử trong giai đoạn nhiễm trùng vỏ rễ (Dixon 1991). Nó tác động đến khả năng miễn dịch của ký chủ làm cho mức độ của xâm nhiễm nhẹ hơn (Dixon 2009b). Một số lượng ngày càng tăng của bo trong đất có thể giúp hạn chế sự xâm nhập động bào tử vào hệ thống rễ (Dixon 2009b). Bo ức chế sự thay đổi cấu trúc từ plasmodium đến bọc bào tử trong quá trình nhiễm của các lông rễ của P. brassicae, qua đó ảnh hưởng đến quá trình phát triển của mầm bệnh.
Nồng độ cao của nitơ trong đất có thể đến quá trình hình thành bệnh và ngược lại, một nồng độ thấp có thể giúp phát triển bệnh và triệu chứng u rễ thể hiện rõ hơn (Webster 1986).
Để quản lý dịch hại cần áp dụng các biện pháp:
Biện pháp canh tác
P. brassicae có khả năng lây nhiễm 300 loài thực vật họ cải. Chính vì vậy, với phổ ký chủ rộng như thế cho phép nó tiếp tục chu kỳ lây nhiễm của mình trong sự vắng mặt của bắp cải. Người ta khó có thể tìm được một công thức luân canh phù hợp để phòng chống tác nhân gây hại này trên những cánh đồng chuyên trồng rau. Ngoài ra, u rễ bắp cải trong chu trình sống của mình có thể hình thành u nang như là một cấu trúc “qua đông” hoàn hảo, có thể bảo vệ chúng ở bất kỳ điều kiện khắc nghiệt nào. Những u này có thể kéo dài nhiều năm trong đất cho đến khi nó tiếp xúc với ký chủ thích hợp, gây ra những khó khăn để phát hiện bệnh.
Mặc dù rất khó để tiêu diệt mầm bệnh một khi nó xuất hiện trên đồng ruộng, nhưng cũng có một số biện pháp để kiểm soát nó bằng cách loại trừ và hạn chế sự phát triển nguồn bệnh như sau:
Chú ý vệ sinh tốt các công cụ và máy móc thiết bị để ngăn chặn sự lây lan các mầm bệnh đến những địa điểm khác. Vệ sinh đồng ruộng cẩn thận trước và sau thu hoạch.
Kiểm soát chặt chẽ các loại cỏ dại, nhất là những cây thuộc họ hoa Thập tự vì mầm bệnh có thể tồn tại trong chúng vô thời hạn và những triệu chứng của u rễ nhiều khi không biểu hiện nên dễ gây tư tưởng chủ quan. Đất làm bầu phải được xử lý cẩn thận trước khi gieo hạt giống.
Chỉ sử dụng nguồn giống ở những địa chỉ tin cậy. Loại bỏ kịp thời những cây con có biểu hiện mắc bệnh.
Một khi bệnh xuất hiện thì cần bón vôi để tăng độ pH của đất lên > 7.2. Vôi không thể diệt được mầm bệnh, nhưng tạo điều kiện ngăn chặn sự hình thành các u rễ. Tuy nhiên việc bón vôi cần tiến hành ngay từ đầu vụ để tránh tác động xấu của nó đối với những cây trồng tiếp theo trong công thức luân canh.
Các bào tử nghỉ ngơi có thể sống sót đi qua hệ tiêu hóa của gia súc, vì vậy cần thận trọng trong việc sử dụng phân hữu cơ.
Sử dụng nước tưới từ nguồn không có mầm bệnh.
Sử dụng những giống kháng trong từng địa phương cụ thể.
Điều chỉnh thời vụ nếu có thể để tránh trồng bắp cải khi nhiệt độ vẫn còn cao.
Biện pháp thuốc BVTV
Sử dụng thuốc BVTV theo 4 đúng.
(Liên hệ với chúng tôi)
D.A.M
